Под теплоёмкостью системы понимают отношение элементарного кол-ва теплоты, которым обменивается сист-ма с о.c в бесконечно малом пространстве изменения состояния к изменению температуры в системе:
СХ = dQX/dT = (∂Q/∂T)X
где х – признак процесса.
[CX] = Дж/град
Удобно использовать не теплоёмкость всей системы, а удельную теплоёмкость, кот. представляет собой отношение теплоёмкости системы к кол-ву вещ-ва в системе (последний м.б в молях). Тогда удельная молярная теплоёмкость: [cXμ] = Дж/(кмоль•К)
Удельная массовая теплоёмкость: [cX] = Дж/(кг•К);
Удельная объёмная теплоёмкость: [c’X] = Дж/(м3•К). при её использовании относят теплоёмкость системы не просто к объёму системы, а к объёму системы, приведенному к нормальным условиям: c’X = cX/VН.
Соотношения м/у вышеуказанными теплоёмкостями следующие:
сХ = сХμ/μ;
c’X = сХμ/22,4;
c’X = сХ•μ /22,4 = сХ/υН, υН – удельный объём при н.у.
сХ = c’X• υН = c’X•22,4/μ.
Из всех процессов и связанных с ними теплоёмкостями наибольший интерес представляют изобарный и изохорный процессы (СР и СV¬). Данные теплоёмкости связаны друг с другом коэфф-том Пуассона или показателем адиабаты:
k = CP/CV; СХ и СР величины, зависящие от температуры системы в процессе:
СР=f(T); CX=f(T); k = f(T).
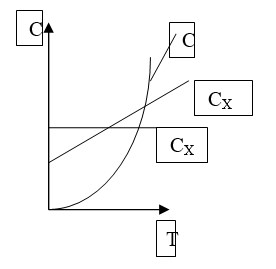
Для анализа тех или иных явлений целесообразно считать CX=const и не зависящей от температуры. В этом случае k оказывается постоянным и равен:
— для одноатомного газа: kI = 1,66;
— для 2-хатомного газа: kII = 1,4;
— для 3-хатомного газа: kIII = 1,33.
Для идеального газа теплоёмкость газа в любом пространстве зависит только от Т. Сказанное выше относится к идеальному газу. Для реального газа в том или ином пространстве теплоёмкость системы зависит от температуры системы и от давления. Теплоёмкость разделяют на истинную и среднюю, выше мы определяли истинную теплоёмкость.
- 10.Май.2015 - Атмосферы в рабочем пространстве высокотемпературной установки
- 10.Май.2015 - Понятие условного топлива и приведенные характеристики
- 10.Май.2015 - Смеси идеальных газов. Закон Дальтона. Формула и определение
- 10.Май.2015 - Требования охраны труда к промышленным предприятиям
- 10.Май.2015 - Температурные графики нагрева и термической обработки садки
